TERMODINÁMICA
- Dentro de la física hay una parte que se denomina termodinámica, ésta describe tres cantidades físicas básicas fundamentales que son:
1 – La entropía
2 – La temperatura
3 – La energía
- Existen unas leyes que son esenciales y describen estos tres principios claramente, las cuales se rigen mediante fórmulas matemáticas y muestran el porqué de los procesos frigoríficos y yo diría que rigen las las leyes del universo.
LA IMPORTANCIA DE LA TERMODINÁMICA EN LOS SISTEMAS FRIGORÍFICOS
Contenido
- ¿ Cuales son las leyes de la termodinámica ?
1 – Ley cero de la termodinámica.
- Si dos sistemas térmicos independientes están en equilibrio con un tercero, todos estarán en equilibrio entre si.
- Pongamos un ejemplo.
- Tenemos una caja de manzanas en un almacén que está a 15ºC, ponemos al lado una caja de naranjas que acabamos de recoger y está a 30ºC, al día siguiente las dos cajas estarán a 15ºC, osea estarán en equilibrio.
- Al día siguiente ponemos al lado una caja de melones que está a 25ºC, pero al cabo de unas horas o días ésta estará a 15ºC como las otras dos.
- Conclusión al final todas las cajas están a 15ºC.
2 – Primera ley de la termodinámica.
- Si en un sistema que está en equilibrio realiza un trabajo o se intercambia calor con otro sistema, su energía interna cambiará.
- También se puede definir al revés.
- ”Si en un sistema aislado la energía no varía, permanecerá constante”.
- Esto también se define como:
- “La energía ni se crea ni se destruye sólo se transforma”.
- Esta ley dice que hay dos tipos de procesos que son:
- Calor
- Trabajo
- Estos pueden provocar un cambio en la energía interna de un sistema.
- Estas magnitudes pueden medirse y cuantificarse, por lo tanto podemos ver un cambio fuera del sistema si se produce un cambio dentro del sistema.
- Sigamos con ejemplos.
- Tenemos un almacén aislado y está a 18ºC, muy bien, pues mientras en este almacén nadie haga nada, nadie introduzca materias calientes, nadie produzca algún tipo de calor dentro, etc, la energía que contiene éste no variará.
Esta ley se puede expresar mediante una fórmula matemática que es:
Qtotal=Qinicial+W
Qtotal: Energía total del sistema
Qinicia: Energía inicial del sistema
W: Energía que añadimos al sistema
- Si el sistema es una cajita pequeñita y ponemos dentro algo calentito, entonces el sistema interno cederá calor a los alrededores (sistema externo),
y en este caso la cajita se calentará un poquito.
- Me apetece pedir una pizza, ya noto la caja calentita. (No suelo comer pizzas, pero, es fácil notar este proceso)
3 – Segunda ley de la termodinámica.
- Esta ley permite regular la dirección de transferencia de energía, siempre de un cuerpo caliente a un cuerpo frío.
- También permite definir la “entropía”:
- La entropía también puede verse como el desorden a nivel microscópico o molecular de un sistema.
- La entropía expresa la capacidad de transformación de la energía, es decir, en un sistema cuanto mayor es su entropía menor capacidad tiene para realizar transformaciones.
- También dice que la entropía interna de cualquier sistema aislado siempre aumenta, ( el universo es el último sistema aislado ), por lo tanto, la entropía del universo siempre aumenta nunca disminuye.
- Los sistemas aislados tienden espontáneamente al equilibrio y este estado es el de máxima entropía.
- Un ejemplo muy utilizado, tenemos nuestro taller, si no lo limpiamos y ordenamos, este se volverá más desordenado y desordenado con el tiempo, independientemente de la intención y cuidado que tengamos en mantenerlo ordenado y limpio.
- Cuando se limpia el taller la entropía disminuye, pero el resultado de ordenarlo y limpiarlo es mayor fuera del sistema y supera la entropía perdida.
4 – Tercera ley de la termodinámica
- La tercera ley de la termodinámica dice que la entropía de un sistema se acerca a un valor constante cuando la temperatura se acerca al cero absoluto ( -273’15 ºk ).
- Al cero absoluto no podemos llegar sólo podemos acercarnos.
Diagrama p-h de la entropía en un refrigerante.
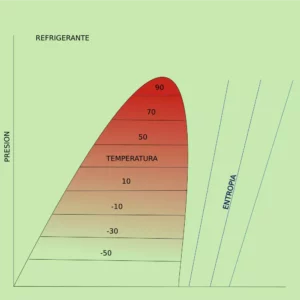
Diagrama p-h de la entropía de compresión de un refrigerante.
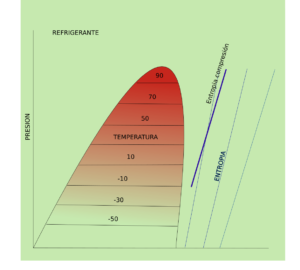
- Como veis la compresión real no es a entropía constante.
- Si aún no lo tenéis claro voy a simplificarlo todavía más.
- Tenemos un sistema, realizamos una transformación, unas materias aumentarán su entropía, otras reducirán su entropía, y al final todo se perderá en el espacio.
- Ahora viene la pregunta más importante: ¿ que sistema creeis que es el más sensible con el medio ambiente, y el más ecológico ?:
- ¿ Un sistema de combustión, o un sistema de resistencias eléctricas, un sistema frigorífico ?.
- Creo que en mi caso lo tengo muy claro.
- Y para terminar vamos a ser prácticos, olvidaros de los precios de todos los sistemas de calefacción, tipo de combustible, componentes del sistema, olvidaros de la entropía y de las leyes de la termodinámica, ahora vamos a reflexionar sobre qué pasa cuando utilizamos esos sistemas.
- Por ejemplo qué pasa cuando utilizamos una caldera de calefacción de pellets, o de gasóleo, o de gas natural etc.
– Primero, el combustible que utilizamos una vez que realiza su transformación, desaparece, es decir, en cuanto lo quemamos deja de existir
y no existirá jamás.
– Segundo, ese calor que obtenemos, después de utilizarlo para nuestros fines, también desaparece, no hay vuelta atrás, y no podemos volver a utilizarlo.
– Tercero, haceros la siguiente pregunta ¿ esto es lo más ecológico para el medio ambiente ?.
- No vamos a entrar en ese debate, reflexionar vosotros mismos, y ahora lo que tenemos que hacer es compararlo con un sistema frigorífico.
– Sigamos con el ejemplo de la calefacción, mediante un sistema frigorífico, cogemos calor del ambiente, lo transformamos y lo entregamos a otro sistema, y para esto utilizamos un trabajo que es muchísimo más pequeño que la energía que transformamos.
-Lo mejor de todo es que, después de que perdemos toda esa energía en forma de calor como en los otros sistemas, podemos volver a cogerla transformarla y utilizarla.
- Tenemos un ciclo constante y solamente utilizamos una pequeñísima cantidad de energía en forma de trabajo.
- Esto ha sido todo por hoy, un saludo para tod@s.

Gracias por el asesoramiento.
De nada